Изучена теплоемкость никелоцена в области 4-300К (рис. 1). Образец вещества, очищенный многократной сублимацией в вакууме, содержал, по данным масс-спектрометрического анализа, 0,1 % мол. примесей. Он загружался в платиновую калориметрическую ампулу в боксе, в атмосфере аргона особой чистоты.
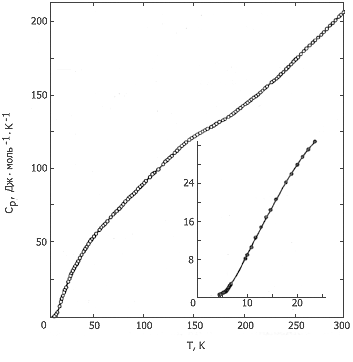
Рис. 1. Температурная зависимость теплоемкости
дициклопентадиенилникеля
На кривой Сp = f(T) наблюдается аномалия в области 100-190К, связанная с λ-переходом. Энтальпия перехода ΔtrH = 182 ± 2 Дж·моль-1, а энтропия ΔtrS = 1,32 ± 0,01 Дж·моль-1К-1. Результаты расчета термодинамических функций Ni(C5H5)2 приведены в таблице 1.
Таблица 1
Теплоемкость и термодинамические функции дициклопентадиенилникеля
| T, K |
Cp,
Дж·моль-1·K-1 |
H°(T)–H°(0),
кДж·моль-1 |
S°(T),
Дж·моль-1·K-1 |
-[G°(T)–H°(0)],
кДж·моль-1 |
| 5 |
0,502 |
0,000502 |
0,117 |
0,000083 |
| 50 |
57,68 |
1,491 |
51,02 |
1,060 |
| 100 |
93,26 |
5,282 |
102,2 |
4,938 |
| 140 |
118,9 |
9,544 |
137,8 |
9,748 |
| 200 |
144,8 |
17,43 |
184,4 |
19,45 |
| 240 |
167,4 |
23,66 |
212,7 |
27,39 |
| 298,15 |
205,6 |
34,50 |
253,0 |
40,93 |
Рассчитаны термодинамические функции газообразного никелоцена в области 298,15-1000К (табл. 2). Расчет проведен в приближении «жесткий ротатор - гармонический осциллятор», в предположении свободного вращения циклопентадиенильных колец в молекуле Ni(C5H5)2.
Таблица 2
Теплоемкость и термодинамические функции дициклопентадиенилникеля в идеальном газовом состоянии
| T, K |
Cp,
Дж·моль-1·K-1 |
S°(T),
Дж·моль-1·K-1 |
[H°(T)–H°(298)]T-1,
Дж·моль-1K-1 |
-[G°(T)–H°(298)]T-1,
Дж·моль-1K-1 |
| 298,15 |
163,6 |
385,8 |
0 |
385,8 |
| 500 |
261,5 |
495,0 |
86,94 |
408,1 |
| 700 |
324,8 |
593,8 |
146,5 |
447,3 |
| 900 |
366,9 |
680,8 |
191,1 |
489,7 |
| 1000 |
383,0 |
720,4 |
209,5 |
510,8 |
Давление насыщенного пара никелоцена в области 353-419К измерено с помощью ртутного манометра. Полученные результаты описываются уравнением RlnP= -ΔsH/T + ΔsCplnT + с, где с = 156,750, a ΔsСp – разность теплоемкостей вещества в газообразном и конденсированном состоянии принята такой же, как и для ферроцена, а именно – 41,8 Дж·моль-1К-1. Из приведенного уравнения получено: ΔsH(298,15) = 72,4 ± 1,3 кДж·моль-1; ΔsS°(298,15) = 242,7 Дж·моль-1К-1; P(298,15) = 1,4799 Па.
В таблице 3 приведены результаты расчета ΔfS° и ΔfG° никелоцена.
Таблица 3
Энтропия и функция Гиббса образования дициклопентадиенилникеля
-ΔfS°(298,15; к),
Дж·моль-1K-1 |
-ΔfS°(298,15; г),
Дж·моль-1K-1 |
-ΔfG°(298,15; к),
кДж·моль-1 |
-ΔfG°(298,15; г),
кДж·моль-1 |
| 486,9 ± 1,4 |
336,6 ± 4,5 |
419,7 ± 4,3 |
447,3 ± 4,6 |
|