Измерена теплоемкость хромоцена в области 4-300К. Образец вещества, по данным масс-спектрометрического анализа, содержал 0,25 % мол. примесей (в основном - С5Н5СrС5Н4СН3). Все манипуляции с веществом проводились в вакууме или в атмосфере аргона особой чистоты, ввиду крайней неустойчивости хромоцена на воздухе. Полученные результаты приведены на рис. 1. Как видно из рисунка, кривая Сp = f(T) хромоцена имеет в области 75-140К четко выраженную аномалию, связанную с переходом в твердом состоянии. При 75К теплоемкость начинает быстро возрастать, достигая максимума 128,2 Дж·моль-1К-1 при 99,7К, затем она падает до 89,79 Дж·моль-1К-1 при 102К. После этого наблюдается еще один пологий пик с максимумом при 118К. Около 140К теплоемкость Сr(С5Н5)2 возвращается к «нормальному» температурному ходу.
В области перехода проводилось несколько серий измерений теплоемкости с различными величинами подъема температуры в опыте (0,2-2,0К) и при разной глубине (до 60; 80; 102К) и скорости (от 1·10-3 до 2·10-2 К·с-1) предварительного охлаждения образца. Во всех сериях опытов для одинаковых температур получены значения теплоемкости, совпадающие в пределах ошибки измерений. Таким образом, наличие второго максимума нельзя объяснить неравновесностью основного перехода. Аналогично тому, как это сделано для ванадоцена, нами рассчитана энтальпия и энтропия перехода: ΔtrН = 265 ± 3 Дж·моль-1; и ΔtrS = 2,57 ± 0,03 Дж·моль-1K-1.
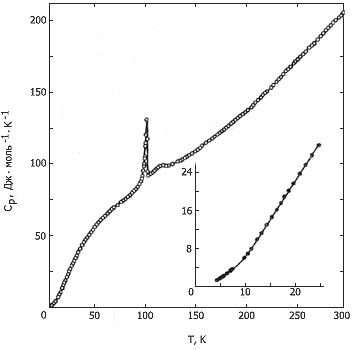
Рис. 1. Температурная зависимость теплоемкости
дициклопентадиенилхрома
Как и для ванадоцена, рассчитаны термодинамические функции хромоцена в области 0-300К (табл. 1).
Таблица 1
Теплоемкость и термодинамические функции дициклопентадиенилхрома
| T, K |
Cp,
Дж·моль-1·K-1 |
H°(T)–H°(0),
кДж·моль-1 |
S°(T),
Дж·моль-1·K-1 |
-[G°(T)–H°(0),
кДж·моль-1 |
| 5 |
1,883 |
0,003515 |
1,083 |
0,001900 |
| 50 |
56,32 |
1,378 |
47,04 |
0,9740 |
| 100 |
120,9 |
5,080 |
96,78 |
4,598 |
| 140 |
102,5 |
8,954 |
129,3 |
9,148 |
| 200 |
133,2 |
16,00 |
170,9 |
18,18 |
| 240 |
158,8 |
21,82 |
197,3 |
25,53 |
| 298,15 |
199,1 |
32,25 |
236,0 |
38,10 |
Изучена теплоемкость хромоцена в интервале 120-298К методом ДСК с погрешностью 3%. Обнаружена аномалия теплоемкости в области 160-240К с максимумом Ср около 214К, связанную с переходом в твердом состоянии, который они интерпретируют как переход типа «порядок - беспорядок». Экспериментальные значения теплоемкости описываются уравнениями:
Сp = -137,7 + 4,042T - 2,482·10-2T2 + 5,809·10-5T3
для области 120-216К и
Ср = 2,2876·104 - 359,87T + 2,0374·T2 - 5,1070·10-3T3 + 4,7903·10-6T4
для области 216-298К.
За исключением области перехода (160-240К), величины Сp меньше полученных данных. Различие составляет для разных интервалов температуры от 0,5% до 3-4%, что близко к погрешности измерений. В то же время область перехода лежит почти на 100К выше, чем по нашим данным. По данным [104] энтальпия перехода составляет 530+20 Дж-моль-1, что в два раза больше полученного нами значения, в то время как энтропия перехода 2,5 + 0,2 Джмоль-1К-1 [104] хорошо согласуется с нашей величиной.
Давление пара хромоцена измерено эффузионным методом Кнудсена в интервале 290-312К. Полученные результаты описываются уравнением lgP(Па) = 11,7 - 3590/7, откуда ΔsH = 68,6 ± 1,7 кДж·моль-1.
Изучено давление пара хромоцена в области 363-519К статическим методом с мембранным нуль-манометром. Средняя величина энтальпии сублимации для интервала 363,2-452,0К равна 65,7 ± 1,5 кДж·моль-1, а энтропия сублимации ΔsS°(T) = 129,7 ± 3,1 Дж·моль-1К-1. Для испарения вещества (интервал 452-519К) получено ΔvH(Т) = 49,6 ± 1,5 кДж·моль-1 и ΔvS(T) = 94,1 ± 3,1 Дж·моль-1К-1. Температура плавления хромоцена равна Тm = 452К, а температура разложения – 533К.
Пересчет ΔsH(Т) к 298,15К с использованием значения ΔsCp = -41,8 Дж·моль-1К-1 дает величину 70,3 ± 1,5 кДж·моль-1. Согласие результатов, полученных разными методами, следует признать хорошим. Для термодинамических расчетов следует рекомендовать, по-видимому, среднее из данных значение
ΔsH(298,15) = 69,4 ± 2,3 кДж·моль-1.
С использованием приведенных выше данных рассчитана стандартная энтропия газообразного хромоцена S°(298,15; г) = 366,4 ± 7,8 Дж·моль-1К-1.
В таблице 2 приведены результаты расчета энтропии и функции Гиббса образования хромоцена.
Таблица 2
Энтропия и функция Гиббса образования дициклопентадиенилхрома
-ΔfS°(298,15; к),
Дж·моль-1K-1 |
-ΔfS°(298,15; г),
Дж·моль-1K-1 |
-ΔfG°(298,15; к),
кДж·моль-1 |
-ΔfG°(298,15; г),
кДж·моль-1 |
| 497,6 ± 1,4 |
367,2 ± 7,9 |
326,6 ± 2,2 |
357,1 ± 3,9 |
|