 |

Закономерности в энтальпиях реакций изомеризации дигалогеналканов

Перемещение атома галогена от первичного атома углерода к вторичному у моногалогеналканов сопровождается тепловым эффектом, равным 2,7 ккал·моль-1. для хлористых и 2,4 ккал·моль-1 для бромистых соединений в жидком состоянии.
Исследование равновесных превращений дигалогенпропанов и дибромбутанов показало, что наличие второго атома галогена в молекуле оказывает значительное влияние на теплоту реакции. Последнее обстоятельство связано с взаимным влиянием связей углерод-галоген, которое определяется расположением атомов галогена в углеродной цепи. В связи с этим представляло интерес исследование изомерных превращений 1,2–, 1,3–, 1,4–дихлорбутанов, т.е. системы с различным удалением атомов хлора друг от друга.
Изомеризацию дихлорбутанов проводили в жидкой фазе в области 0–120°С в присутствии AlCl3, количество которого варьировалось в пределах 20–30% вес. Равновесие достигалось при изомеризации 1,2– и 1,3–дихлорбутанов и в некоторых случаях – при изомеризации чистого 1,4–дихлорбутана. Изомеризация последнего протекает трудно, требует большого содержания катализатора, длительного времени реакции и сопровождается значительным смолообразованием. 1,2– и 1,3–дихлорбутаны изомеризуются легко. Анализ равновесных смесей проводили методом газо-жидкостной хроматографии. Были определены константы равновесия для 0, 30, 60, 90, 120°С, которые позволили рассчитать уравнения для констант равновесия исследуемых реакций, значения ΔrH°(T) и ΔrS°(T) в жидкой фазе (табл. 1).
Таблица 1
Основные характеристики реакций изомеризации 1,2–, 1,3–, 1,4–дихлорбутанов.
| Реакция |
Уравнение для Kp |
ΔrH°(T),
ккал·моль-1 |
ΔrS°(T),
кал·моль-1град-1 |
CH2Cl–CHCl–CH2–CH3 →
→ CH2Cl–CH2–CHCl–CH3 |
lgKp = 374/T – 0,1 |
– 1,17 |
– 0,46 |
CH2Cl–CH2–CH2–CH2Cl→
→ CH2Cl–CHCl–CH2–CH3 |
lgKp = 142/T – 0,012 |
– 0,65 |
+ 0,06 |
CH2Cl–CH2–CH2–CH2Cl→
→ CH2Cl–CH2–CHCl–CH3 |
lgKp = 516/T – 0,088 |
– 2,36 |
– 0,40 |
Как показывают данные таблицы 1, наблюдается заметное изменение теплового эффекта реакции при перемещении одного из атомов хлора по цепи. Так, для третьей реакции вместо ожидаемой величины –2,7 ккал·моль-1 получено значение –2,36 ккал·моль-1, а для второй реакции эта величина падает до –0,65 ккал·моль-1.
Полученные результаты вместе с имеющимися в настоящее время данными по изомеризации аналогичных дибромбутанов, а также с данными по дигалогенпропанам позволяют проследить общую тенденцию к изменению тепловых эффектов изомеризации дигалогеналканов С3–С4. В таблице 2 приведены значения тепловых эффектов основных типов реакций перемещения одного из галогенов по цепи.
Таблица 2
Теплоты реакций изомеризации дигалогеналканов в жидкой фазе.
| Тип реакции |
ΔrH°(T),
ккал·моль-1 |
| Х = Cl |
Х = Br |
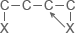 |
–2,36 |
–1,85 |
 |
–0,65 |
–0,42 |
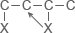 |
1,71 |
1,43 |
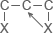 |
–1,45 |
–1,13 |
Для реакций первого типа падение энтальпии изомеризации против соответствующего моногалогенпроизводного составляет 0,34 ккал·моль-1 для хлористых и 0,55 ккал·моль-1 для бромистых соединений. Это падение будет определяться взаимодействием связей углерод-галоген в положении 1,3. Для реакций второго типа падение энтальпии изомеризации связано со взаимным влиянием связей углерод-галоген, находящихся в виц-положении. Падение энтальпии равно 2,05 ккал·моль-1 для хлористых и 1,98 ккал·моль-1 для бромистых.
Тепловой эффект реакций третьего типа определяется разностью между взаимным влиянием атомов галогена в положениях 1,2 и 1,3. Для хлористых имеем величину 1,71 ккал·моль-1 и для бромистых 1,43 ккал·моль-1. Этот тип реакций аналогичен четвертому типу для изомеризации дигалогенпропанов, для которых подобные значения соответственно равны 1,35 и 1,27 ккал·моль-1, т. е. близкие к величинам реакций третьего типа.
Таким образом, можно сделать вывод, что для жидкой фазы изменение тепловых эффектов изомеризации дигалогеналканов против соответствующих моногалогеналканов будет, по-видимому, определяться только положением связей углерод-галоген независимо от типа галогена.
|
|